Hướng dẫn về thiết bị y tế hạng 1
Hướng dẫn này áp dụng cho các nhà sản xuất thiết bị y tế hạng I, bao gồm các phụ kiện nhưng không bao gồm các thiết bị dành cho điều tra lâm sàng và các thiết bị được chế tạo riêng
Nếu bạn là nhà sản xuất hoặc đại diện được ủy quyền đặt thiết bị y tế trên thị trường EU, bạn nên tham khảo những điều sau để xác nhận rằng sản phẩm của bạn nằm trong định nghĩa của thiết bị y tế:
• Quy định về thiết bị y tế 2002
• các quy tắc phân loại thiết bị trong Phụ lục IX của Chỉ thị về Thiết bị Y tế (93/42/EEC – MDD)
• Hướng dẫn của Ủy ban Châu Âu – MEDDEV2.1 / 6 : http://ec.europa.eu/DocsRoom/documents/10337/attachments/1/translations
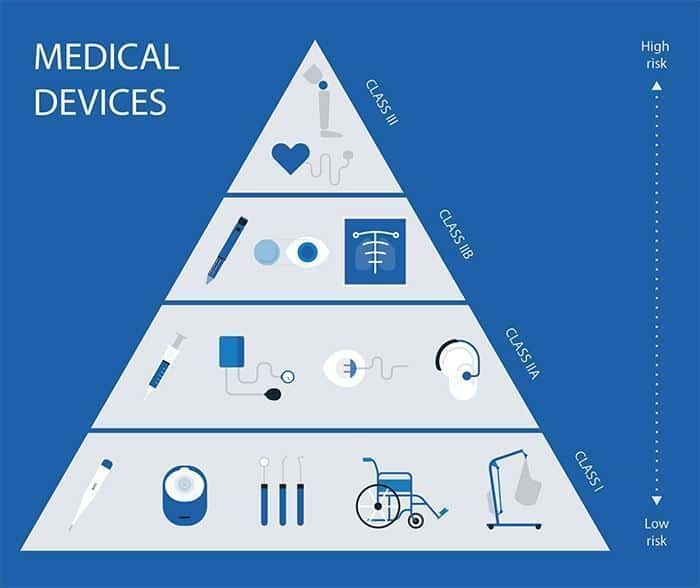
Tóm tắt các yêu cầu đối với Nhà sản xuất thiết bị Class I
• xác nhận rằng các sản phẩm của bạn là thiết bị y tế Class I như được mô tả trong Phụ lục IX của MDD
• kiểm tra xem các sản phẩm của bạn có đáp ứng các yêu cầu thiết yếu có liên quan của Phụ lục I của MDD không
• thực hiện đánh giá lâm sàng như được mô tả trong Phụ lục X của MDD
• chuẩn bị tài liệu kỹ thuật
• nếu thiết bị y tế của bạn vô trùng hoặc có chức năng đo, hãy thông báo cho cơ quan thông báo
• soạn thảo ‘Tuyên bố về sự phù hợp của EC’
• đặt dấu CE trên thiết bị của bạn như được mô tả trong Điều 17 của MDD
• đăng ký với ISO-CERT
• thực hiện và duy trì các quy trình hành động và cảnh giác khắc phục bao gồm một quy trình có hệ thống để xem xét kinh nghiệm thu được trong giai đoạn hậu sản xuất
• cung cấp tài liệu liên quan nếu ISO-CERT yêu cầu
Đánh dấu CE
Dấu CE là logo được nhà sản xuất đặt trên các thiết bị y tế để cho biết rằng sản phẩm của họ phù hợp với yêu cầu của chỉ thị. Nó chỉ ra rằng thiết bị hoạt động theo đúng mục đích đã định và đáp ứng các luật liên quan đến an toàn và hiệu suất. Một sản phẩm mang nhãn hiệu CE có thể được bán tự do ở bất cứ đâu trong Liên minh châu Âu.
Bạn phải ký ‘tuyên bố về sự phù hợp’ trước khi bạn có thể đặt dấu CE trên sản phẩm của mình.
Đối với các thiết bị vô trùng và đo lường, dấu CE cũng phải có số nhận dạng của cơ quan được thông báo đã phê duyệt phần này của đánh giá sự phù hợp.

Tài liệu kỹ thuật
Bạn phải giữ tài liệu kỹ thuật chứng minh rằng các sản phẩm của bạn phù hợp với các yêu cầu của MDD . Bạn phải chuẩn bị tài liệu này trước khi lập tuyên bố về sự phù hợp của EC. Bạn phải giữ tài liệu trong khoảng thời gian kết thúc ít nhất 5 năm sau khi các sản phẩm cuối cùng được sản xuất. ISO-CERT có thể yêu cầu xem tài liệu bất cứ lúc nào.
Các tài liệu kỹ thuật phải bao gồm tất cả các khía cạnh được liệt kê dưới đây.
Sự miêu tả
Mô tả chung về sản phẩm, bao gồm mọi biến thể (ví dụ tên, số kiểu và kích cỡ).
Tài liệu thô và thành phần
Thông số kỹ thuật như: chi tiết nguyên liệu; bản vẽ của các thành phần và / hoặc mẫu chủ; thủ tục kiểm soát chất lượng.
Sản phẩm trung gian và tài liệu lắp ráp phụ
Thông số kỹ thuật bao gồm: bản vẽ phù hợp và / hoặc các mẫu chính; Chu trình; đặc điểm kỹ thuật xây dựng; phương pháp sản xuất có liên quan; thủ tục kiểm soát chất lượng.
Tài liệu sản phẩm cuối cùng
Thông số kỹ thuật bao gồm: bản vẽ phù hợp và / hoặc các mẫu chính; Chu trình; đặc điểm kỹ thuật xây dựng; phương pháp sản xuất có liên quan; thủ tục kiểm soát chất lượng.
Tài liệu đóng gói và dán nhãn
Thông số kỹ thuật đóng gói và bản sao của tất cả các nhãn và bất kỳ hướng dẫn sử dụng.
Xác minh thiết kế
Kết quả kiểm tra trình độ và tính toán thiết kế có liên quan đến mục đích sử dụng của sản phẩm, bao gồm các kết nối với các thiết bị khác để sản phẩm hoạt động như dự định.
Phân tích rủi ro
Xem xét liệu các rủi ro liên quan đến việc sử dụng sản phẩm có tương thích với bảo vệ sức khỏe và an toàn ở mức độ cao hay không và có thể chấp nhận được khi cân nhắc với lợi ích cho bệnh nhân hoặc người dùng. Ví dụ: nếu tính tương thích sinh học có liên quan (nghĩa là đối với các thiết bị xâm lấn), bạn sẽ cần phải biên dịch và xem xét dữ liệu hiện tại hoặc báo cáo thử nghiệm dựa trên các tiêu chuẩn có liên quan.
Tuân thủ các yêu cầu thiết yếu
Bạn cần chứng minh rằng bạn đáp ứng các yêu cầu thiết yếu có liên quan được nêu trong phụ lục 1 của MDD . Không phải tất cả các yêu cầu thiết yếu sẽ áp dụng cho sản phẩm của bạn, vì vậy bạn sẽ cần xác định những yêu cầu nào được áp dụng và cung cấp bằng chứng để chứng minh cách bạn đáp ứng những yêu cầu này. Một cách để chứng minh rằng bạn đáp ứng các yêu cầu thiết yếu cụ thể là phát triển sản phẩm của bạn theo các tiêu chuẩn hài hòa ( Harmonised Standards ) có liên quan . Tài liệu kỹ thuật cần bao gồm một mô tả về cách từng yêu cầu thiết yếu có liên quan được tuân thủ bao gồm danh sách các tiêu chuẩn hài hòa có liên quan đã được áp dụng, toàn bộ hoặc một phần, liên quan đến sản xuất và thiết kế sản phẩm.
Đánh giá lâm sàng theo Phụ lục X
Một đánh giá lâm sàng của các tài liệu khoa học có liên quan hiện có liên quan đến sự an toàn, hiệu suất, đặc điểm thiết kế và mục đích dự định của thiết bị. Dữ liệu cần phải chứng minh đầy đủ rằng sản phẩm đáp ứng mục đích của nó. Mục đích dự định bao gồm bất kỳ khiếu nại nào được đưa ra như một phần của tài liệu tiếp thị bổ sung cho những tuyên bố trong tệp kỹ thuật.
Tuyên bố EC về sự phù hợp
Để đặt dấu CE trên các sản phẩm của bạn, bạn phải tuân theo tuyên bố về quy trình tuân thủ EC được mô tả trong Phụ lục VII của MDD. Bạn phải làm điều này trước khi đặt thiết bị trên thị trường.
Bạn phải giữ tài liệu trong khoảng thời gian kết thúc ít nhất 5 năm sau khi các sản phẩm cuối cùng được sản xuất. Điều này là để ISO-CERT có thể điều tra bất kỳ vấn đề nào với một thiết bị ngay cả khi nó không còn trên thị trường.
Ngoài ra, nếu bạn sản xuất các thiết bị vô trùng hoặc đo lường, bạn phải cung cấp bất kỳ thông tin nào khác cho quy trình đánh giá sự phù hợp cụ thể, chẳng hạn như phê duyệt của cơ quan và tài liệu hệ thống chất lượng được thông báo.
Đánh giá lâm sàng
Bạn phải thực hiện đánh giá lâm sàng cho tất cả các thiết bị Class I để chứng minh sự phù hợp với các yêu cầu thiết yếu của MDD . Việc đánh giá bao gồm xem xét dữ liệu lâm sàng được công bố để chứng minh rằng thiết bị y tế hoạt động như dự định và an toàn khi sử dụng.
Hướng dẫn của Ủy ban Châu Âu MEDDEV2.7 / 1 mô tả những gì được mong đợi trong một đánh giá.
Lưu ý: đánh giá lâm sàng không giống như điều tra lâm sàng (CI). Một CI có thể là một phần của đánh giá lâm sàng. Ví dụ: nếu không có đủ bằng chứng tồn tại trước đó để chứng minh rằng thiết bị phù hợp với các yêu cầu thiết yếu của MDD, thì một CI được thiết kế cụ thể có thể là cần thiết. Trong trường hợp này, bạn sẽ phải thông báo cho ISO-CERT trước khi thực hiện điều tra. Tài liệu MEDDEV 2.7 / 4 của Ủy ban Châu Âu bao gồm hướng dẫn về việc quyết định xem bạn có cần làm CI hay không.
Đánh giá lâm sàng của thiết bị cần phải được xem xét liên tục sau khi thiết bị đã được đưa ra thị trường. Đánh giá của bạn nên tính đến kết quả của bất kỳ hoạt động giám sát thị trường bài đăng hoặc phản hồi của người dùng. Các tài liệu kỹ thuật nên được cập nhật cho phù hợp.
Yêu cầu thêm cho các thiết bị vô trùng Class I
Bạn sẽ phải tìm một cơ quan được thông báo phù hợp để được chấp thuận cho các khía cạnh của sản xuất liên quan đến việc đảm bảo và duy trì các điều kiện vô trùng . Bạn chỉ có thể yêu cầu một cơ quan được thông báo bất cứ lúc nào để phê duyệt các phạm vi sản phẩm cụ thể và họ sẽ tính phí cho các dịch vụ của họ. Tên và địa chỉ của các cơ quan được thông báo của Vương quốc Anh có trên trang này , mặc dù bạn có thể sử dụng bất kỳ cơ quan được thông báo nào đã được chỉ định để chứng nhận các thiết bị y tế theo MDD ở Châu Âu.
Yêu cầu thêm cho các thiết bị Class I có chức năng đo
 Các thiết bị Class I được coi là có chức năng đo nếu chúng là ống tiêm có chỉ báo âm lượng hoặc chúng là thiết bị đo thông số sinh lý và hiển thị hoặc chỉ ra giá trị trong một đơn vị đo phù hợp với mục đích dự định. Các ví dụ bao gồm nhiệt kế, nhiệt kế mắt và máy theo dõi chức năng phổi bao gồm máy đo công suất quan trọng.
Các thiết bị Class I được coi là có chức năng đo nếu chúng là ống tiêm có chỉ báo âm lượng hoặc chúng là thiết bị đo thông số sinh lý và hiển thị hoặc chỉ ra giá trị trong một đơn vị đo phù hợp với mục đích dự định. Các ví dụ bao gồm nhiệt kế, nhiệt kế mắt và máy theo dõi chức năng phổi bao gồm máy đo công suất quan trọng.
Các thiết bị kết hợp các chỉ báo chỉ hiển thị thay đổi về mức độ hoặc trạng thái mà không chỉ ra giá trị cụ thể hoặc chỉ ra giá trị cụ thể không liên quan trực tiếp đến an toàn của bệnh nhân, không thể hiện chức năng đo theo MDD .
Tài liệu hướng dẫn của Ủy ban Châu Âu MEDDEV 2.1 / 5 cung cấp thêm thông tin về các thiết bị có chức năng đo.
Bạn sẽ cần sử dụng một cơ quan được thông báo phù hợp để có được sự chấp thuận cho các khía cạnh của sản xuất liên quan đến các yêu cầu đo lường (ví dụ như hiệu chuẩn và kiểm tra).
Giám sát sau thị trường, hành động khắc phục và thủ tục cảnh giác
Bạn phải thông báo ngay cho ISO-CERT nếu bạn phát hiện ra rằng sản phẩm của bạn có liên quan đến sự cố:
• dẫn đến nguy hiểm chết người.
• dẫn đến thương tích nghiêm trọng hoặc suy giảm nghiêm trọng sức khỏe của bệnh nhân, người dùng hoặc người khác.
• có thể dẫn đến tử vong, chấn thương nghiêm trọng hoặc suy giảm nghiêm trọng về sức khỏe.
Bạn cũng phải thông báo cho ISO-CERT về bất kỳ lý do kỹ thuật hoặc y tế nào dẫn đến việc thu hồi thiết bị.
Bạn phải đưa ra và cập nhật, một quy trình được lập thành tài liệu để xem xét kinh nghiệm thu được từ các thiết bị trên thị trường và thực hiện bất kỳ hành động khắc phục cần thiết nào, theo tính chất và rủi ro liên quan đến sản phẩm. Điều này được gọi là “giám sát sau thị trường”. Ủy ban Châu Âu đã ban hành ‘Hướng dẫn về hệ thống cảnh giác các thiết bị y tế’ .
Các tình huống trong đó thiết bị loại 1 sẽ không được coi là tuân thủ Quy định về Thiết bị Y tế bao gồm:
• nó không được đánh dấu CE
• thiết bị y tế hiển thị dấu CE nhưng nhà sản xuất đã không đáp ứng các yêu cầu được nêu trong MDD
• nhà sản xuất hoặc đại diện được ủy quyền không được đăng ký với cơ quan có thẩm quyền của EU
• dữ liệu lâm sàng được cung cấp cho ISO-CERT không bao gồm đánh giá tất cả các tài liệu khoa học được công bố có liên quan và do đó hiệu quả của thiết bị bị phóng đại
Các yêu cầu bổ sung
Phthalates
Việc sử dụng phthalates trong thiết kế và xây dựng một thiết bị y tế phải được chứng minh trong tài liệu kỹ thuật. Điều này là do phthalates có thể gây ung thư, gây đột biến hoặc gây độc cho sinh sản. Biện minh phải tính đến phân tích lợi ích rủi ro của việc sử dụng một chất như vậy.
Nếu việc sử dụng phthalates là hợp lý, thì hướng dẫn sử dụng phải bao gồm thông tin về mọi rủi ro liên quan đến việc sử dụng sản phẩm có chứa phthalates.
Hơn nữa, một thiết bị y tế có chứa phthalates phải được dán nhãn theo yêu cầu thiết yếu 7.5 của phụ lục 1 của MDD nếu thiết bị này được dự định:
• quản lý và / hoặc loại bỏ thuốc, dịch cơ thể hoặc các chất khác đến hoặc ra khỏi cơ thể
• vận chuyển và lưu trữ thuốc, dịch cơ thể hoặc các chất khác sẽ được sử dụng
Một ví dụ về thiết bị Class I trong đó phthalates có thể là một vấn đề là đường ống trong bộ quản trị.
Máy móc
Các thiết bị y tế cũng là máy móc cũng phải đáp ứng các yêu cầu thiết yếu có liên quan của Chỉ thị Máy móc Directive 2006/42/EC . Ủy ban Châu Âu đã đưa ra một tài liệu diễn giải về chủ đề này.
Thiết bị bảo hộ cá nhân (PPE)
Một số thiết bị y tế chia sẻ đặc điểm với PPE. Đối với những sản phẩm này, bạn sẽ cần phải ghi rõ pháp luật sản phẩm của bạn đã được đánh dấu CE theo các thiết bị y tế, PPE hoặc cả hai. Mục đích đã nêu, mục đích của thiết bị sẽ đưa ra đánh giá sự phù hợp mà bạn sẽ phải làm. Ủy ban Châu Âu đã đưa ra một tài liệu diễn giải về chủ đề này.
Doanh nghiệp có nhu cầu tư vấn hồ sơ xin cấp chứng nhận CE Marking cho thiết bị y tế thuộc loại 1 ( Class I ) để đủ điều kiện vào thị trường EU xin vui lòng liên hệ với đơn vị chúng tôi qua thông tin sau:
————————————————————————————
VĂN PHÒNG CHỨNG NHẬN QUỐC TẾ ISO-CERT
Adress: HH2A Khu đô thị Linh Đàm – Hoàng Mai – Hà Nội
Hotline: 0904.889.859 – 0904.889.859 (Ms.Hoa)
Website: https://iso-cert.vn
Email: vanphongisocert@gmail.com


 Găng tay CE Marking – Tiêu chuẩn PPE ( Thiết bị bảo vệ cá nhân R425/2016/EU)
Găng tay CE Marking – Tiêu chuẩn PPE ( Thiết bị bảo vệ cá nhân R425/2016/EU)
