Chỉ thị về Thiết bị y tế (93/42 / EEC) là gì?
Chỉ thị 93/42 / EEC của Liên minh Châu Âu (EU) (còn được gọi là Chỉ thị về Thiết bị Y tế – MDD) chi tiết các nhà sản xuất và nhà nhập khẩu Yêu cầu thiết yếu phải đáp ứng để áp dụng nhãn CE và tiếp thị hợp pháp hoặc bán thiết bị của họ tại EU. Do có nhiều loại thiết bị được MDD bảo vệ, các yêu cầu cụ thể phụ thuộc vào việc phân loại và mục đích sử dụng của thiết bị. Tuy nhiên, trong hầu hết các trường hợp, việc sử dụng Cơ quan Thông báo của EU là cần thiết để đánh giá việc tuân thủ Chỉ thị trước khi có thể áp dụng nhãn CE cho thiết bị.
Thiết bị y tế là bất kỳ dụng cụ, thiết bị hoặc thiết bị nào được sử dụng để chẩn đoán, theo dõi hoặc điều trị bệnh, chấn thương hoặc tàn tật ở người. Thuật ngữ thiết bị y tế trực tiếp, áp dụng cho một loạt các sản phẩm, thiết bị và thiết bị, từ thuốc giảm đau lưỡi đơn giản và khăn trải giường đến các thiết bị phẫu thuật laser. Các thiết bị y tế cũng có thể bao gồm một số thiết bị phát xạ bức xạ điện tử với các ứng dụng y tế, bao gồm các thiết bị siêu âm và máy X-quang.
Mặc dù thuật ngữ này được áp dụng rộng rãi, các thiết bị y tế không nên bị nhầm lẫn với các nhóm sản phẩm khác được sử dụng để điều trị các điều kiện y tế. Ví dụ, thuốc và chế phẩm dược phẩm, điều trị các điều kiện y tế thông qua hành động hóa học hoặc do cơ thể chuyển hóa, không được coi là thiết bị y tế và phải tuân theo các quy định và yêu cầu khác nhau.
Tại sao các thiết bị y tế phải được đánh dấu CE?
Dấu CE cho thấy các thiết bị y tế đáp ứng luật pháp hiện hành của EU. Dấu CE có nghĩa là các thiết bị y tế có thể được bán trên thị trường EU, miễn là các thiết bị đáp ứng các yêu cầu quốc gia (ví dụ về yêu cầu đăng ký và ngôn ngữ )
Lệnh điều hành trên các thiết bị y tế quy định rằng một thiết bị y tế phải có dấu CE trước khi nó có thể được đưa ra thị trường. Trong bối cảnh này, tiếp thị đề cập đến lần đầu tiên một thiết bị y tế được cung cấp để phân phối hoặc sử dụng (ví dụ: cho nhà phân phối, chuyên gia chăm sóc sức khỏe hoặc bệnh nhân). Điều này áp dụng cho dù thiết bị mới hoặc được tân trang gần đây và liệu nó có được cung cấp miễn phí hay không.
Tuy nhiên, không có yêu cầu pháp lý đối với việc đánh dấu CE đối với các thiết bị, các gói và thiết bị điều trị y tế tùy chỉnh để điều tra lâm sàng.
Đáp ứng các quy định thiết bị y tế của EU
Là một thực thể có trách nhiệm, bạn phải đảm bảo rằng thiết bị y tế của bạn và tài liệu của nó đáp ứng chỉ thị của thiết bị y tế EU. Bạn bắt đầu từ đâu Mỗi trường hợp là khác nhau và có đặc điểm độc đáo riêng của nó. Chúng tôi có nhiều năm kinh nghiệm trong chứng nhận sản phẩm y tế tại EU và quốc tế, và cung cấp chứng nhận nhanh chóng và phù hợp với thiết bị y tế của bạn. Chuyên gia tư vấn của chúng tôi có kiến thức đầy đủ về các tiêu chuẩn phân loại thiết bị y tế của EU, vì vậy nếu bạn không chắc chắn liệu sản phẩm của mình có được phân loại là thiết bị y tế ở Châu Âu hay không, chúng tôi có thể xác nhận cho bạn. Với quy trình chứng nhận của chúng tôi, chúng tôi đảm bảo thiết bị y tế và tài liệu của bạn sẽ đáp ứng tất cả các điều khoản bắt buộc. Tất cả chúng ta cần là thông tin cụ thể của thiết bị y tế và chúng tôi sẽ sắp xếp phần còn lại.
Phân loại thiết bị y tế
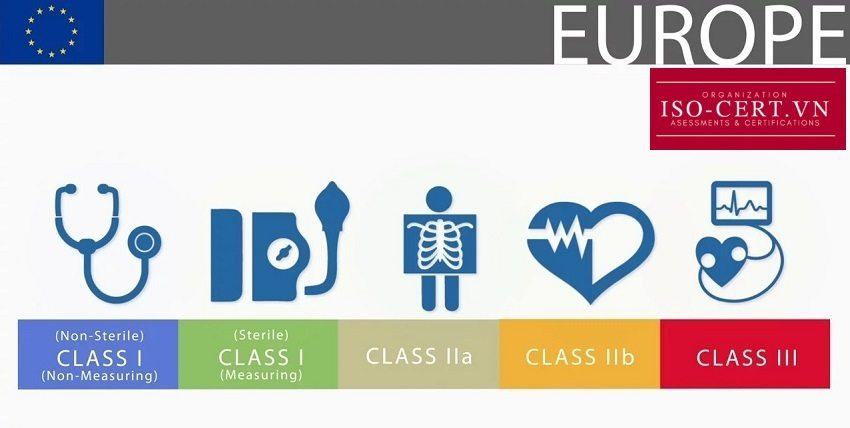
Việc phân loại thiết bị y tế là phần thiết yếu nhất của chứng nhận vì đây là cơ sở cho con đường thực hiện sự phù hợp. Một thiết bị y tế là một khái niệm rất rộng, ví dụ như viện trợ ban nhạc là một thiết bị y tế cũng như máy tạo nhịp tim. Các thiết bị này đều thuộc Quy định về Thiết bị Y tế. Để phân biệt các thiết bị này, chúng được phân loại trong các lớp rủi ro khác nhau. Các nhóm rủi ro được chia thành Loại I, IIa, IIb và III. Một thiết bị trong Class I là một thiết bị có rủi ro thấp và một thiết bị của Class III có rủi ro cao. Việc phân loại rất phụ thuộc vào đặc điểm của thiết bị y tế.
Các nhà sản xuất thiết bị loại Class I (vô trùng / đo lường) (sterile / measuring) , IIa, IIb và III phải được chứng nhận theo chỉ thị đánh dấu CE, 93/42 / EEC, từ Cơ quan thông báo trước khi sử dụng nhãn CE và đưa sản phẩm ra thị trường.
Đánh dấu CE của các thiết bị y tế đòi hỏi phải có tài liệu kỹ thuật (nghĩa là – Hồ sơ kỹ thuật hoặc Hồ sơ thiết kế) Không cần phân loại thiết bị. Tuy nhiên, việc phân loại thiết bị có tác động đáng kể đến các lộ trình phê duyệt theo quy định có sẵn cho công ty của bạn. Do đó, bước đầu tiên trong quy trình Đánh dấu CE của các thiết bị y tế là xác định phân loại rủi ro. Có bốn phân loại thiết bị: Class I, IIa, IIb và III.
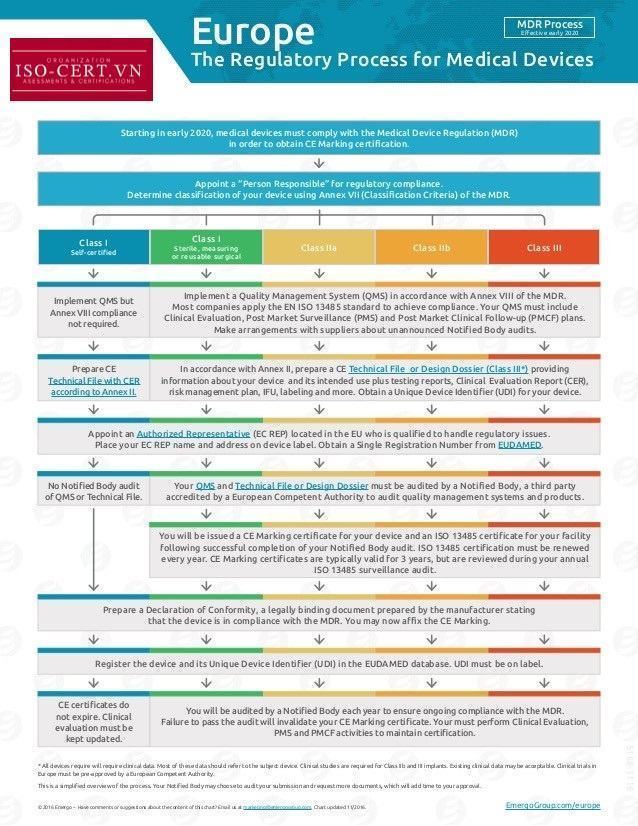
Khi công ty của bạn đã xác định phân loại rủi ro của thiết bị, thì bạn phải xác định quy trình đánh giá sự phù hợp mà bạn sẽ tuân theo để nhận được phê duyệt CE Marking. Các quy trình đánh giá sự phù hợp có sẵn cho từng phân loại được xác định trong Điều 11 của Chỉ thị Thiết bị Y tế và chi tiết bổ sung được cung cấp trong các Phụ lục khác nhau (ví dụ: – Phụ lục II, III, IV, V, VI và VII). Bảng dưới đây tóm tắt các tùy chọn cho từng phân loại:
Nếu sản phẩm của bạn là thiết bị Loại Class I : Non-sterile & Non-measuring ( không vô trùng và không đo lường), thì bạn sẽ không yêu cầu Cơ quan Thông báo (NB). Tuy nhiên, tất cả các sản phẩm khác sẽ yêu cầu công ty của bạn chọn NB
Quy trình đánh dấu CE cho sản phẩm
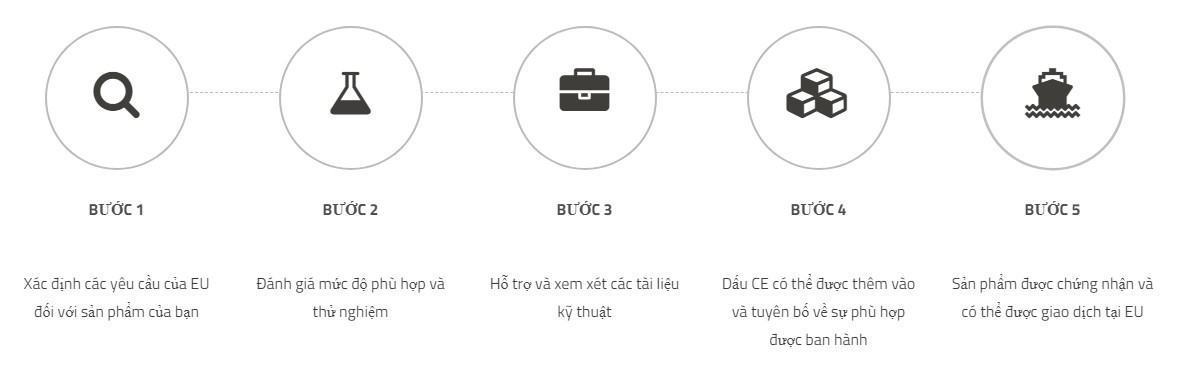
Bước 1: Xác định các yêu cầu của EU đối với sản phẩm của bạn
Bước 2: Đánh giá mức độ phù hợp
Bước 3: Hỗ trợ & xem xét các tài liệu kỹ thuật
Bước 4: Dấu CE có thể được thêm vào và tuyên bố về sự phù hợp, được phép ban hành
Bước 5: Sản phẩm của bạn được chứng nhận và có thể được giao dịch trong thị trường EU
Các lựa chọn chứng nhận theo chỉ thị này bao gồm Phụ lục II, V và VI bao gồm kiểm toán trang web và đánh giá tài liệu kỹ thuật. Kiểm toán của chúng tôi thường sẽ đánh giá việc tuân thủ cả ISO 13485:2016 và chỉ thị 93/42/EEC.
Loại đánh giá bạn chọn có thể là:
- Kiểm tra và thử nghiệm từng sản phẩm hoặc lô sản phẩm đồng nhất (Phụ lục IV của MDD )
- Kiểm toán hệ thống đảm bảo chất lượng sản xuất (Phụ lục V của MDD )
- Kiểm toán kiểm tra và thử nghiệm cuối cùng (Phụ lục VI của MDD )
- Kiểm toán hệ thống đảm bảo chất lượng đầy đủ (Phụ lục II của MDD )
Lợi ích khi làm việc với ISO-CERT
Các cơ quan thông báo được chính quyền ủy quyền để đảm bảo rằng các nhà sản xuất thiết bị y tế có tài liệu kỹ thuật cần thiết và thực hiện kiểm soát chất lượng cho các quy trình và sản phẩm có thể gây rủi ro đáng kể.
Một cơ quan được thông báo phải được tham gia trước khi tiếp thị bất kỳ thiết bị y tế nào, ngoại trừ các thiết bị loại I không bao gồm các sản phẩm vô trùng hoặc chức năng đo, các thiết bị được chế tạo tùy chỉnh cũng như các thiết bị chẩn đoán in vitro không được bao gồm trong phụ lục II.
- Kinh nghiệm trong thế giới chứng nhận thiết bị y tế.
- Hướng dẫn độc lập thông qua toàn bộ quá trình chứng nhận.
- Chúng tôi sẽ liên lạc với các Cơ quan Thông báo thay mặt bạn.
Đánh dấu CE
Khi nhà sản xuất đã ký tuyên bố về sự phù hợp của EU, dấu CE có thể được đặt trên thiết bị. Dấu CE phải được đặt rõ ràng, rõ ràng và không thể xóa được trong hướng dẫn sử dụng và là biểu tượng mà sản phẩm tuân thủ các yêu cầu pháp lý.
Dấu CE cũng phải được dán vào bao bì và trên thiết bị. Trên các thiết bị vô trùng, phải đặt dấu CE trên bao bì đảm bảo vô trùng cho thiết bị. Số nhận dạng cho một cơ quan được thông báo phải được đặt dưới dấu CE.
Dấu CE được thể hiện trong phụ lục XII của các lệnh điều hành trên các thiết bị y tế.
Đăng ký CE MARKING đối với Thiết bị y tế tại Việt Nam:
Sự công nhận của tổ chức kiểm định IAS Hoa Kỳ và liên kết chặt chẽ với Ủy ban Châu Âu và Cơ quan có thẩm quyền khiến chúng tôi trở thành đối tác tự nhiên để đáp ứng các yêu cầu chứng nhận CE của bạn. Hợp tác với ISO-CERT cho phép doanh nghiệp của bạn tiếp cận với kiến thức chuyên môn, mạng lưới kiểm toán viên toàn cầu và cơ hội kết hợp Đánh dấu CE với nhiều chứng nhận quy định khác của chúng tôi trong một cuộc kiểm toán.
————————————————————————————
VĂN PHÒNG CHỨNG NHẬN QUỐC TẾ ISO-CERT
Adress: HH2A Khu đô thị Linh Đàm – Hoàng Mai – Hà Nội
Hotline: 0904.889.859 – 0904.889.859 (Ms.Hoa)
Website: https://iso-cert.vn
Email: vanphongisocert@gmail.com


 Tại Sao CE MARKING là “Hộ Chiếu” hàng hóa vào thị trường Châu Âu ( EU )
Tại Sao CE MARKING là “Hộ Chiếu” hàng hóa vào thị trường Châu Âu ( EU ) Chứng nhận CE marking Thiết bị y tế
Chứng nhận CE marking Thiết bị y tế
