Các bước tuân thủ thiết bị y tế loại I
- Phân loại: đảm bảo thiết bị là thiết bị y tế loại I.
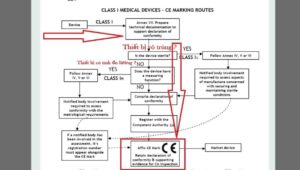
- Chọn lộ trình đánh giá sự phù hợp: tham khảo biểu đồ dòng chảy bên dưới .
- Biên dịch tệp kỹ thuật.
- Tuyên bố về sự phù hợp.
- Chỉ định một Đại diện ủy quyền. (đăng ký với Cơ quan có thẩm quyền)
- Cảnh giác và giám sát thị trường bài. (đóng dấu CE và tiếp thị sản phẩm)
Thiết bị y tế loại I: Lộ trình đánh giá sự phù hợp
Các tuyến đánh giá sự phù hợp cho các thiết bị y tế loại I
- Nhà sản xuất chịu trách nhiệm đảm bảo rằng sản phẩm của mình tuân thủ tất cả các Yêu cầu thiết yếu có liên quan của Chỉ thị và phải đưa ra một tuyên bố bằng văn bản cho hiệu ứng này (tự khai báo).
- Thiết bị y tế loại I không có chức năng đo và được cung cấp trong điều kiện không vô trùng ( Ví dụ như: Khẩu trang y tế, Quần áo phòng dịch…..( loại không vô trùng ) ). KHÔNG yêu cầu sự tham gia của Cơ quan thông báo . Sự phù hợp với Tiêu chuẩn quốc tế và Châu Âu EN hay ISO 13485 là tự nguyện . ( Ví dụ
- Các nhà sản xuất các sản phẩm và thiết bị vô trùng có chức năng đo phải nộp đơn cho Cơ quan Thông báo để chứng nhận các khía cạnh của sản xuất liên quan đến vô trùng hoặc đo lường .
- Khi nhà sản xuất hài lòng rằng các sản phẩm của mình đáp ứng tất cả các Yêu cầu thiết yếu có liên quan, nhà sản xuất hoặc Đại diện ủy quyền châu Âu của mình nếu nhà sản xuất nằm ngoài EEA, phải đăng ký với Cơ quan có thẩm quyền (CA). Sau đó, anh ta có thể đóng dấu CE trên các sản phẩm của mình và đặt chúng trên thị trường EEA.
Trích nguồn thông tin tại: http://www.ce-marking.com/medical-devices.html#whichclassification


 CẤP CHỨNG NHẬN CE MARKING KHẨU TRANG Y TẾ XUẤT KHẨU EU
CẤP CHỨNG NHẬN CE MARKING KHẨU TRANG Y TẾ XUẤT KHẨU EU Download Tải Về Logo CE MARKING dán nhãn
Download Tải Về Logo CE MARKING dán nhãn Chứng nhận CE marking Thiết bị y tế
Chứng nhận CE marking Thiết bị y tế
